Вестерн-Блот
Содержание
- Введение
- Растворы
- Лизис образца
- Подготовка образца
- Проведение электрофореза
- Перенос белка из ПААГ на мембрану
- Окраска мембраны
Введение
Вестерн-блоттинг - аналитический метод, используемый для определения специфичных белков в образце, разделенных путем электрофореза в полиариламидном геле. Далее белки из геля переносят на нитроцеллюлозную или PVDF мембрану, затем детектируют исследуемые белки с использованием антител, специфичных к конкретному белку и проявляют, используя вторичные антитела.
Растворы
Буфер для лизиса
Буфер NP-40
150 мМ NaCl
1,0% NP-40 (Tergitol® тип NP-40)
50 мМ Трис-HCl, pH 8,0
Ингибиторы протеаз
Sample буфер (x5)
10% SDS
5% 2-меркаптоэтанол
50% глицерин
0,01% бромфеноловый синий
0,4 М Имидазол
Проверить pH и довести до pH 6,8
Разделяющий буфер (буфер нижнего, разделяющего геля)
400 мМ Трис-HCl
0,1% SDS
0,01% TEMED
0,1% персульфат натрия
Проверить pH и довести до pH 8,3
Буфер для переноса (полусухой)
16 мМ Трис-HCl
200 мМ Глицин
0,1% SDS
20% метанол
Проверить pH и довести до pH 8,3
Буфер для блокировки
150 мМ NaCl
10 мМ Na2HPO4
3-5% обезжиренного сухого молока
Проверить pH и довести до pH 7,5
Буфер для промывки (PBST)
150 мМ NaCl
10 мМ Na2HPO4
0,2% Tween-20
Проверить pH и довести до pH 7,5
Лизис образца
Приготовление лизата из культуры клеток
1. Поместите емкость с клетками на лед и промойте клетки охлажденным раствором PBS.
2. Полностью удалите раствор PBS, затем добавьте охлажденный буфер для лизиса (1 мл на 107клеток/150 см2; 0,5 мл на 5x106клеток/75 см2).
3. Отделите клетки от пластика, затем аккуратно перенесите суспензию клеток в охлажденную пробирку для центрифугирования.
4. Инкубируйте пробирку с суспензией при постоянном перемешивании в течение 30 минут при +4℃.
5. Отцентрифугируйте суспензию при +4℃. Реккомедуемая стандартная скорость 12000 об/мин в течение 20 мин, однако эти параметры необходимо определять для конкретного эксперимента и типа клеток.
6. Отберите полученный супернатант
Приготовление лизата из тканей
1. Отделите часть исследуемой ткани, используя чистые инструменты.
2. Поместите ткань в пробирку для центрифугирования. Добавьте в пробирку охлажденный буфер для лизиса (0,3 мл/5 мг ткани). Измельчите образец, использую гомогенизатор. Промойте лезвия гомогенизатора 0,2 мл охлажденным буфером для лизиса. Смыв добавьте к образцу. Избегайте излишнего разбавления образца. Минимальная концентрация при нагрузке составляет 0,1 мг/мл. Оптимальный диапазон - 1-5 мг/мл
3. Инкубируйте пробирку с суспензией при постоянном перемешивании в течение 2 часов при +4℃
4. Отцентрифугируйте суспензию при 12000 об/мин в течение 20 минпри +4℃
5. Отберите полученный супернатант
Подготовка образца
1. Определите концентрацию белка в полученных лизатах.
2. Определите необходимое для нагрузки количество белка и добавьте к образцу 5X Sample буфер в 4 раза меньшем объеме.
Мы рекомендуем использовать восстановленные и денатурированные образцы
3. Для восстановления и денатурации образца его необходимо прокипятить в Sample буфере при +100℃ в течение 5 мин.
Проведение электрофореза
Поместите одинаковые количества образцов и маркера молекулярных весов в лунки полиакриламидного геля. Нагрузка для лизата должна составлять 20-30 мкг общего содержания белка, нагрузка для чистого белка - 10-100 нг.
Проведите электрофорез белков в полиакриламидном геле
| Размер белка | % ПААГ |
| 10-40 кДа | 15 - 20 % |
| 40-100 кДа | 10 - 15 % |
| 100-300 кДа | 5 - 10 % |
| > 300 кДа | 5 % |
Возможно использование градиентных гелей
Перенос белка из ПААГ на мембрану
Для переноса можно использовать нитроцеллюлозную или PVDF мембрану. Активируйте PVDF мембрану предварительно вымочив ее в течение 1 минуты в метаноле. Перед проведением переноса, промойте ее в буфере для переноса. Мы рекомендуем использовать полусухой способ переноса белков на мембрану. Степень переноса белков на мембрану можно проверить, используя краску Ponceau S, перед блокировкой мембраны.
Подготовьте мембрану для переноса в соответствии с рисунком
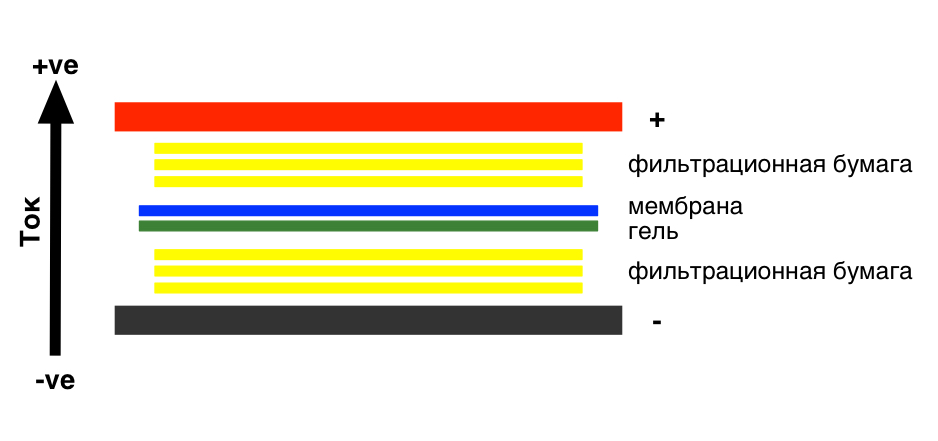
Окраска мембраны
1. Ополосните мембрану раствором PBS.
2. Для блокировки мест неспецифического связывания проинкубируйте мембрану в буферном растворе для блокировки в течение ночи при +4℃ или в течение 40 минуту при +37℃ и постоянном перемешивании.
3. Для отмывки мембраны проинкубируйте ее 3 раза в растворе PBST в течение 5 минут при +37℃ и постотоянном перемешивании.
4. Проведите инкубацию с антителами к исследуемому белку в растворе PBS в течение 40 минут при +37℃ и постотоянном перемешивании.
5. Для отмывки мембраны проинкубируйте ее 3 раза в растворе PBST в течение 5 минут при +37℃ и постотоянном перемешивании
6. Проведите инкубацию мембраны с вторичными антивидовыми антителами (иммуноконъюгаты) в растворе PBS течение 40 минут при +37℃ и постотоянном перемешивании.
7. Промойте мембрану 5 раз в растворе PBST в течение 5 минут при +37℃ и постотоянном перемешивании.
8. Для детекции связавшихся антител, конъюгированных с пероксидазой хрена, рекомендуем использовать субстратный раствор DAB.



